
 |
|
Главная страница Влажный воздух [0] [1] [ 2 ] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] с:ц,,,,,>1,>1,:,>1с,,ц,,,,ц, -/.2. Идеальный гэз iic************************ 1.2. Идеальный газ Простая гомогенная система в каждом равновесном состоянии характеризуется определёнными значениями параметров состояния V, р и Г. Между ними существует зависимость F{p, v, Т) = О, которая называется термическим уравнением состояния. Но состояние системы вполне определяется заданием двух из этих параметров, так что третий параметр является для каждого равновесного состояния функцией двух других. Таким образом, можно записать, что p = f,{v,T), v = f2(p,n T = f{v,p). Термическое уравнение состояния газов при малых давлениях принимает простое выражение. Если по измеренным значениям р, v и Г рассчитать величину pv/T, то lim- = const = /?. (1.3) Константа R называется газовой постоянной и имеет для каждого газа своё значение. Она представляет собой работу 1 кг газа при постоянном давлении и при изменении температуры на 1 градус. Поведение этой величины для воздуха представлено на рис. 1.4. Как видно из рисунка, предельное условие справедливо не только при /? = О, но и выдерживается с достаточно хорошим приближением при невысоких давлениях воздуха. Штриховые горизонтальные линии на рис. 1.4 выделяют области отклонений pvJT от предельного значения R по уравнению (1.3). Заштрихованная область охватывает возможный диапазон температур и давлений для систем комфортного кондиционирования, поэтому в качестве термического уравнения состояния воздуха можно использовать простые зависимости pv = RT, pV = mRT, p = pRT. (1.4) Газы, строго подчиняющиеся уравнению (1.4), называются идеальными, а само уравнение pv = RT - термическим уравнением состояния идеальных газов, или уравнением Клапейрона. При так называемых нормальных условиях (р = 101,325 кПа, Т = 273,15 К) объём 1 кмоль идеального газа vp (произведение удельного объёма v на его молекулярную массу р) есть величина постоянная и равна 22,4143 мкмоль (закон Авогадро). Произведение [iR носит название универсальной газовой постоянной. Её значение может быть вычислено из уравнения (1.4) для 1 кмоль газа „ рК 101325-22,4143 о,,, „ LLi? = - =---= 8314,2 Дж/(кмоль-К). Т 273,15 V J 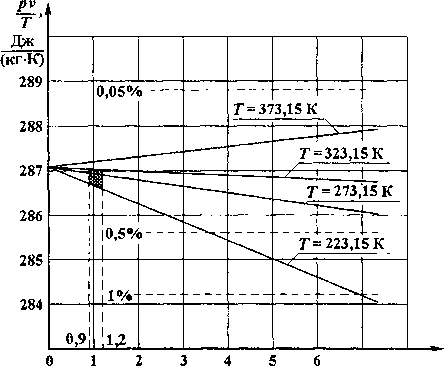 710 р,кПя Рис. 1.4. Зависимость газовой постоянной для воздуха от давления при различной температуре Для иллюстрации использования уравнений в нижеприводимых примерах расчёта будем предполагать, что реальные газы подчиняются уравнению состояния идеального газа. примеры Пример 1.1. При нормальных условиях (ро = 101,325 ьсПа, Т-213,15 К) масса кислорода О2, содержащегося в 1 кг сухого воздуха, равна wq =0,2315 кг, а объём Vq = 0,1621 м . Определить газовую постоянную, удельный объём и плотность. Из уравнения (1.4) РО. 101325 0,1621 „ , Ro, =-~ = .„. = 259,75 Дж/(кгК). 2 mQ Т 0,2315 • 273,15 Удельный объём Vq = - = 0,7002 м Vict. ИО2 Плотность кислорода «О, 1 Ро, =-;г = -= Ь4281кг/м Пример 1.2. На входе в подогреватель газ имеет следующие параметры: =101,6 кПа и Г, =248,15 К. Аэродинамическое сопротивление аппарата 275 Па. Температура газа на выходе = 298,15 К. Определить удельный объём и плотность газа на входе и выходе из подогревателя (считать Л = 259,75 Дж/(кгК)). Из уравнения (1.4.) находим удельный объём Vj и плотность р на входе в подогреватель RT 259,75-248,15 3, V, = -- =---- = 0,6344 м /кг; р 101600 р, = - = -- = 1,5763 кг/м\ vj 0,6344 Давление газа на выходе Р2 =101 600-275 = 101 325Па. Тогда на выходе из аппарата RT2 259,75-298,15 . .3. = -- =-= 0,7643 м /кг; 2 Р2 101325 р - ± = -1- = 1 3084 кг/и\ 2 V2 0,7643 Пример 1.3. Определить газовую постоянную азота. Молекулярная масса азота = 28,0134. Используя значение универсальной газовой постоянной, получим 2 28,0134 [0] [1] [ 2 ] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] 0.009 |