
 |
|
Главная страница Влажный воздух [0] [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [ 14 ] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] iii>*** If Ki*** н> * ****** III** * 3.1. Общие положения *****»******н,*********** Для перегретого пара:
По формуле fi = Л - 75 вычисляем значения химического потенциала:
Зависимость химического потенциала от температуры представлена на графике, из которого видно, что равенство химических потенциалов = ц" (точка А) наступает при t„ = 32,9°С и ц = -8,0 кДж/кг. Действительно, из термодинамических таблиц свойств воды и водяного пара в состоянии насыщения имеем: при р» = 5 кПа t» = 32,9°С. Для воды при f„ = 32,9°С Л = 137,77 кДж/кг us = 0,4762 кДж/(кгК). Откуда ц = 8,0 кДж/кг. Для насыщенного пара Л"= 2561,2 кДж/кг и s" = = 8,2952 кДж/(кг-К). Следовательно, ц." = 8,0 кДж/кг. Левее точки v4 химический потенциал воды меньше химического потенциала пара, т. е. р < р". Так, например, если бы пар с температурой 32°С (точка В) находился в контакте с водой, имеющей ту же температуру, то условия теплового (3.5) и механического (3.6) равновесия соблюдались бы, но условие равенства химических потенциалов было бы нарушено. Это приводит к переходу вещества в фазу с меньшим значением химического потенциала, т. е. более устойчивую при данных условиях, поэтому переохлажденный пар должен сконденсироваться. Обратная картина будет иметь место для точки С. 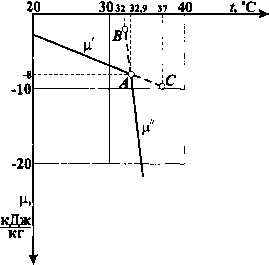 Условия термодинамического равновесия (3.4) - (3.6) можно записать в виде уравнения \х(р,Т) = i"(p,7), из которого видно, что обе фазы имеют одинаковые давление и температуру. Давление /?„ и температура Г„ насыщенного пара в условиях фазового перехода связаны между собой, что позволяет найти уравнение кривой пар о-образования />„ =/(Г„). Для химического потенциала с учётом вьфажения (3.1) dfi = - 5dr„ + vd/7„, di" = - 5"dr„ + v"dp. Так как изменения химического потенциала каждой фазы при переходе равны между собой, т. е. dp = di", то -/dГ-vф«=-5"dГ«+v>«. Откуда dT (v"-v) Имея в виду, что теплота фазового перехода г = ThCS" - s), окончательно получим =--. (3.7) dr„ r„(v"-v) Полученное уравнение связывает давление насыщения р н с температурой Гн и носит название уравнения Клапейрона-Клаузиуса. В основу вывода уравнения легли термодинамические положения, которые справедливы и для фазовых переходов вода - лёд и лёд - водяной пар. Следовательно, это уравнение справедливо в указанных случаях при замене г теплотой соответствующего фазового перехода, а объёмов жидкости и пара - объёмами соответствующих фаз. Каждый из трёх фазовых переходов является изобарным и изотермическим, поэтому значения теплоты перехода равны разности энтальпий фаз Количество теплоты, затрачиваемое на парообразование 1 кг воды при температуре кипения до сухого насыщенного пара, называется теплотой парообразования г. Следовательно, r = h"-h = T,{s" - s) = r„(v" - v) . (3.9) Не Не Не «Не Не Не Не Не Id Не Не Не Не Не Не Не Не Не Не «Не Не Не 3.1. Общие положения t*********************** Количество теплоты, которое необходимо затратить на плавление 1кг льда при температуре плавления, называется теплотой плавления г. Таким образом, пл=Л-\ = Г„(5-5,) = Г„(у-у,). (3.10) Количество теплоты, которое необходимо затратить на сублимацию 1 кг льда при температуре сублимации, называется теплотой сублимации ryg. Откуда суб = Л" - \ = - ) = (V" - Vл ) §. (3.11) Следует отметить, что вода по сравнению с другими жидкостями обладает аномальностью свойств. Максимальная плотность воды при нормальном давлении наблюдается при температуре 4°С. У подавляющего большинства веществ объём твёрдой фазы меньше объёма жидкой фазы. Для воды объём льда больше, чем объём воды в момент фазового перехода, т. е. v -Уц< 0. Это и объясняет аномальный ход кривой затвердевания воды, когда с повышением давления температура затвердевания уменьшается. Действительно, из уравнения Клапейрона-Клаузиуса сле- дует, что =--, но поскольку г„„ и Г„ всегда положи- dr„ r„(v-v) » тельны, а величина (v - ) для воды отрицательна, то производная будет меньше нуля. Это значит, что угол наклона каса- тельной к линии затвердевания в p-f-диаграмме будет больше 90°, т. е. кривая с повышением давления будет отклоняться влево. Более подробно эти вопросы будут затронуты при рассмотрении области воды и плавления льда в 5-г-диаграмме. 4 Зак, 3799 [0] [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [ 14 ] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] 0.0086 |