
 |
|
Главная страница Полупроводниковые электровакуумные приборы [0] [1] [ 2 ] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [66] [67] [68] [69] [70] [71] [72] [73] [74] [75] [76] [77] [78] [79] [80] [81] [82] [83] [84] [85] [86] [87] [88] [89] [90] [91] [92] [93] [94] [95] [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] [106] [107] [108] [109] [110] [111] [112] [113] [114] [115] [116] [117] [118] [119] [120] [121] [122] [123] [124] [125] [126] [127] [128] [129] [130] [131] [132] [133] [134] [135] [136] [137] [138] [139] [140] [141] [142] [143] [144] [145] 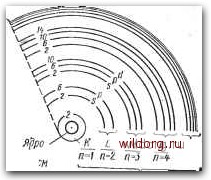 Номера оЪолочек Рис. 2.1. Структура электронных оболочек изолированного атома бом описания поведения элементарных частиц исходя-из энергетического спектра атомов и твердых тел. Структура электронных оболочек атома. Атом любого вещества содержит положительно заряженное ядро и систему эллиптических орбит, по которым перемещаются электроны. Совокупности близко расположенных орбит образуют электронные оболочки. Для упрощения анализа предполагают, что электроны перемещаются по наиболее простым круговым траекториям, лежащим в одной плоскости. Это позволяет задавать орбиту электрона лишь одним орбитальным параметром - номером оболочки п, получившим наименование главного квантового числа. Электронные оболочки, объединяющие группу близко расположенных орбит электронов, в атоме обозначают буквами К, L, М, Q или цифрами п=1, 2, 7 (рис. 2.1). Первая оболочка (К или п=1) содержит лишь одну орбиту. В соответствии с принципом запрета, сформулированным в 1925 г. Паули, в атоме не может быть двух электронов с одинаковыми квантовыми числами. Это значит, что первая оболочка может быть занята лишь-двумя электронами, но с противоположными спинами (моментами), обеспечивающими вращение электронов вокруг своей оси в противоположных направлениях. Вторая и последующие оболочки содержат по нескольку подгрупп орбит. Подгруппы орбит в оболочке обозначаются буквами: 2 (s, р), 3 (s, р, d) и т. д. Количество оболочек и подгрупп в них, заполненных электронами, увязано с номером элемента в таблице Д. И. Менделеева. Наибольшее число электронов в каждой обо лочке N=2rfi. Так, вторая оболочка (L или п=2) содержит N2= =2п2=2-22=8 электронов, которые расположены на двух (s и р) подгруппах орбит. Первая подгруппа (s) содержит одну орбиту, занятую двумя электронами, а вторая (р)-три по-разному ориентированные в пространстве орбиты, занятые шестью электронами (по два на каждой орбите). Структура третьей оболочки (М или п=3), содержащей А/з=2п2=2-32= 18 электронов, состоит из трех подгрупп орбит, занятых в каждой подгруппе соответственно 2, 6 и 10 электронами. Энергетическая структура атома. В понятие электронной оболочки вкладывается энергетический смысл. Каждой орбите оболочки присущ определенный энергетический уровень, который условно отражает энергетическое состояние электрона в атоме. В нормальном состоянии (при отсутствии внешних воздействий) электроны в атоме заполняют низшие разрешенные уровни. Если атому сообщить извне дополнительную энергию, то за счет этой энергии электрон может преодолеть силу притяжения ядра и перейти на более высокий свободный энергоуровень (наступает возбуждение атома) или вовсе покинуть атом (происходит ионизация атома). Энергия возбуждения \Vs=eUB и ионизации WiseUj зависит от соответствующих потенциалов и и. Потенциал воз- буждения может составить /7е-1-20 В, а ионизации - 6и4-=-25 В. В возбужденном состоянии электроны пребывают недолго, около 10-* с, после чего возвращаются в исходное состояние. При этом они выделяют квант энергии в виде электромагнитного излучения с,частотой где V - частота электромагнитного излучения электрона; Wi-Wi - разность энергий электрона до и после перехода с одного уровня на другой. Полная энергия электрона на орбите складывается из его кинетической и потенциальной энергии. По мере приближения электрона к -ядру происходит уменьшение потенциальной энергии. Очевидно, когда электрон достигнет ядра, его потенциальная энергия равна нулю. С увеличением номера электронных оболочек [орбитального числа п (см. рис. 2.1)] уменьшается разность уровней энергии электронов смежных орбит. В этой области переход электронов с одной оболочки на другую сопровождается излучением, которое лежит в оптическом спектре (инфракрасной, видимой или ультрафиолетовой его областей) с относительно малой энергией квантов света. Если же переход электронов происходит между внутренними оболочками (например. К, L, М), близко расположенными к ядру, то излучение происходит в рентгеновской части спектра с большой энергией квантов. Электроны внутриатомных оболочек находятся под действием значительных сил притяжения к ядру. Испускание электронов из этих оболочек возможно лишь в случаях, когда атому сообщается большая энергия. Напротив, электроны внешних (валентных) оболочек атомов, слабо связанные с ядром, требуют меньших затрат дополнительной энергии для возбуждения и ионизации, легко вступают в связи с атомами других веществ и участвуют во многих электронных явлениях. На рис. 2.2 схематически представлена энергетическая диаграмма электронных оболочек изолированного атома. На ней по оси ординат отложены значения энергии электронов на оболочках. Уровни энергии изображены горизонтальными линиями. Длина этих линий произвольна и физического смысла не имеет. Для удобства изображения за нуль отсчета принят уровень электронов валентной оболочки 2 (рис. 2.2, а) невозбужденного атома. Ниже него располагаются рентгеновские уровни соответствующие внутриатомным  зп <1 оую к) 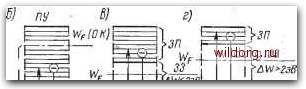 Рис. 2.2. Диаграмма энергетических уровней атома и твердых тел оболочкам, а выше - уровни возбуждения 3 и ионизации 4. Валентные электроны, переходя на этот уровень, теряют связь с ядром и становятся свободными. Дальнейшая передача энергии этим электронам вызовет лишь увеличение их кинетической энергии. Энергетическая диаграмма твердого тела; В атомах твердых тел распределение электронов по уровням энергии также подчиняется законам квантовой статистики. Остается в силе и запрет Паули. Электроны внутренних оболочек остаются связанными с ядром своего атома, а электроны внешних (валентных) оболочек, кроме этого, связаны со смежными атомами. Эта система связей определяет положение атомов в кристаллической решетке твердого тела. При сближении атомов и образовании кристаллической решетки твердых тел происходит смещение энергетических уровней электронов соответствующих оболочек взаимодействующих однородных атомов. Оно приводит к образованию непрерывного спектра. Совокупности близко расположенных дискретных уровней электронов однородных атомов твердого тела образуют энергетические зоны (рис. 2.2, б-г). Энергетические уровни внутриатомных оболочек образуют сравнительно узкие энергозоны. Электроны этих зон в явлениях электропроводимости участия не принимают, поэтому здесь и не рассматриваются. Совокупность уровней энергии в.алентных электронов взаимодействующих атомов образует валентную зону ВЗ. Средний потенциал решетки твердого тела принимают равным верхней границе (потолку) валентной зоны. Он соответствует основному уровню ОУ (валентному уровню) в энергоструктуре изолированного атома (см. рис. 2.2, а). При внешнем энерговоздействии (тепло, электромагнитное излучение, бомбардировка быстрыми частицами) некоторые электроны могут выйти из связей в атомах и перейти из валентной зоны на более высокие уровни энергии. Совокупность уровней энергией, которые занимают электроны при выходке из связей (при ионизации атомов), образует зону проводимости ЗП. Электроны этой зоны, теряя связь с ядром, относительно свободно перемещаются в потенциальном поле атомов кристаллической решетки твердого тела и улучшают его проводимость. Между валентной зоной и зоной проводи-; [0] [1] [ 2 ] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [66] [67] [68] [69] [70] [71] [72] [73] [74] [75] [76] [77] [78] [79] [80] [81] [82] [83] [84] [85] [86] [87] [88] [89] [90] [91] [92] [93] [94] [95] [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] [106] [107] [108] [109] [110] [111] [112] [113] [114] [115] [116] [117] [118] [119] [120] [121] [122] [123] [124] [125] [126] [127] [128] [129] [130] [131] [132] [133] [134] [135] [136] [137] [138] [139] [140] [141] [142] [143] [144] [145] 0.0238 |